新品推薦
ELISPOT Part 4---- ELISPOT關于細胞處理相關問題介紹
一、細胞處理
接下來,我們會從細胞的來源,如何培養,以及使用的培養基等幾個方面詳細的給大家介紹一下細胞樣本是如何處理的。
1. ELISpot 和 FluoroSpot適用于多種細胞類型
細胞可以來源于各種來源以及不同的物種。比如培養的細胞系、人的全血或小鼠的脾臟。來自于粘膜組織的細胞也能應用于ELISpot。同時來源于不同物種的靜脈血和脾臟細胞也可用于ELISpot,例如猴子、小鼠、大鼠、牛、馬、羊、豬等。
2. 較常用的細胞--外周血單個核細胞(PBMC)
我們可以很容易地通過密度梯度離心法從血液中獲得外周血單個核細胞(Peripheral blood mononuclear cells, PBMC)。提取出來的PBMC可以直接使用,也可以被凍存,用于以后的ELISpot/FluoroSpot實驗。對于人來源的PBMC樣本,血液樣本中應該加入檸檬酸鈉抗凝或者直接使用肝素抗凝管收集。
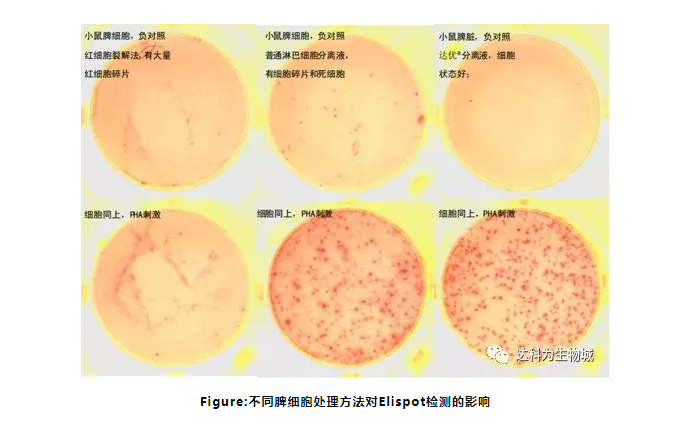
3. 細胞的質量是影響實驗結果至關重要的因素
在活細胞中,細胞凋亡的比例都不高,能夠正常的分泌蛋白質,不會對實驗結果產生影響。細胞處理過程的標準化對于成功的細胞檢測是至關重要的,特別是對于ELISPOT/FLUOROSPOT實驗。從血液樣本中提取出來的PBMC,超過3小時就可能被活化的粒細胞污染,進而影響實驗結果。
解決這一問題的三種方法:
①在保存過程中輕輕攪拌血液樣品;
②在保存樣本前,用PBS或RPMI1:1稀釋血液樣本;
③在檢測前去除血液樣本中的粒細胞。
4. 實驗中可以使用凍存的細胞
在 ELISPOT 檢測的應用中,往往需要用到凍存的淋巴細胞樣品作為檢測細胞。由于 ELISPOT檢測的是細胞的免疫功能,不僅僅需要保持細胞的存活率,而且還要保證細胞的功能不發生變化。傳統的細胞凍存方法通常是為了保存細胞株,對細胞存活率的要求不高,更沒考慮保持細胞原有的免疫狀態,所以傳統的細胞凍存方法已經不能滿足 ELISPOT 檢測的要求。
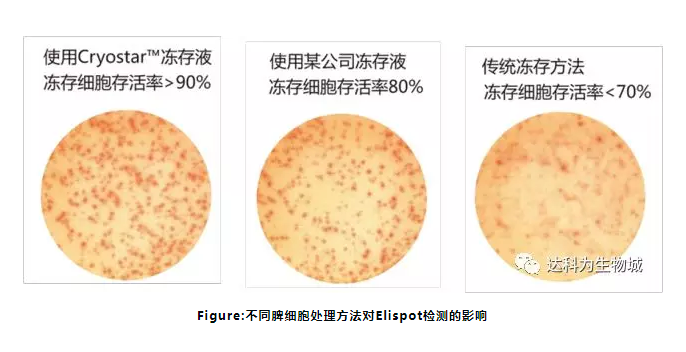
5. 細胞復蘇
細胞凍存和復蘇都會導致不同數量的細胞死亡,這在我們復蘇后并不能馬上觀察到。我們建議復蘇后的細胞在37°C新鮮的培養基中放置1小時或更長時間。 這樣細胞碎片就可以很容易地被去除,并提高了檢測性能。
二、ELISpot和FluoroSpot的血清和培養基
細胞培養環境能夠影響我們的實驗結果,其中培養基起著至關重要的作用。請考慮以下方面,以產生高效的細胞培養物。
1. 培養基
用于ELISpot和FluoroSpot的細胞培養基應與待測細胞相容。 RPMI培養基常與血清一起使用。如果在細胞培養過程中CO2受到限制,可以加入HEPES以維持細胞培養的pH值。通常推薦使用青霉素和鏈霉素等抗生素來降低污染的風險。
2. 血清
我們應選擇一些既可以支持細胞培養,同時背景值又比較低的一些血清。并且血清本身不應引起非特異性的細胞活化或蛋白分泌。我們建議使用胎牛血清。血清批次間可能會有所不同,在ELISpot和FluoroSpot實驗前我們最好測試一下新的批次。我們一般推薦血清熱滅活。不推薦人血清,因為它可能含有能干擾檢測的異嗜性抗體或固有分析物。
3. 無血清培養基---消除血清中不確定成份的影響
含替代血清成分從而提高細胞培養和實驗結果的重復性:
▲維持淋巴細胞存活,保持細胞活力和免疫功能狀態
▲不會額外刺激陰性細胞產生額外產生任何一種細胞因子
▲不會抑制陽性細胞分泌各種因子

產品優勢:
▲成分固定,徹底消除了批次間的差異。
▲不含雜蛋白,背景更弱,斑點更清晰。
▲不含抑制細胞因子分泌成分,斑點更多,更加反映真實的結果。
三、細胞稀釋指南
1. 活細胞計數
用臺盼藍或細胞計數儀檢測活細胞的數量。評估凋亡細胞的數量是一個優勢。
2. 計算需要的細胞數
計算所需的細胞數量和所需的體積。建議制備過量的細胞懸浮液(10-20%),以確保有足夠的體積用于實驗。
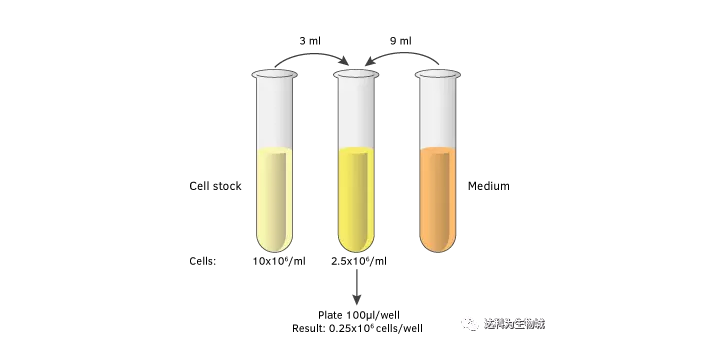
3. 加入適量的培養基
將培養基加入到細胞懸浮液中。用于T細胞檢測的細胞濃度通常在0.5×106/ml和3×106/ml之間。
4. 混勻
充分混勻細胞懸液。
5. 將細胞懸浮液移到孔板中
在向孔板中加入細胞之前,應該先添加刺激物。另一種方法是將細胞和刺激物充分混勻后再加到孔板中。將細胞懸浮液移到孔板中。如果同時操作一個以上的孔板,應在加入細胞懸液前在重新混勻一下細胞懸液。一個孔板大約需要12ml。
建議稀釋的步驟:
四、細胞孵育
1. 細胞數
每個孔中細胞的數量必須與細胞類型和細胞分泌的頻率相適應。如果頻率非常低,例如在10000個細胞中有1個,那么我們就需要更多數量的細胞,通常有250000個細胞/孔。當頻率較高時,例如在10個細胞中就有1個,那么我們僅需要大約5000個細胞/孔就足夠了。
2. 測定細胞線性度
在分析中,如果發現細胞沒有成線性關系,可能是由于細胞數量不夠,或者細胞刺激不夠造成的。比如當分析抗原特異性T細胞時,PBMC細胞數不應低于每孔200000個細胞。
3. 激活
在加入細胞之前,應將刺激物添加到孔板中,或者刺激物與細胞混勻后一起加入到孔板中。細胞被添加到孔板中后就不能再添加更多的培養基,因為后加入的培養基會使細胞向邊緣周圍擴散。在ELISPOT/FLUPOSBOT讀板前,應清洗細胞以避免膜的背景染色。在B細胞ELISPOT實驗中洗板是很重要的。
4. 動力學
在建立適合細胞孵育時間時,應考慮蛋白質分泌的動力學因素。某些分析物僅在刺激超過24小時后才會分泌。
5. 濕度
我們要確保足夠的濕度來培養細胞。建議培養過程中用錫箔紙包裹孔板,避免蒸發。一般的建議,37°C ,5% CO2孵育細胞。
6. 靜置
避免細胞在培養過程中突然移動,因為這將對斑點的形成產生不利的影響。

前三期詳情請參考:
ELISpot Part 1——ELISpot原理、優勢及品牌推薦
ELISPOT Part 2-T細胞、B細胞ELISPOT介紹以及Mabtech相關產品
ELISpot Part 3——ELISpot的對照設置及不同的刺激物簡介
四、細胞孵育
1. 細胞數
每個孔中細胞的數量必須與細胞類型和細胞分泌的頻率相適應。如果頻率非常低,例如在10000個細胞中有1個,那么我們就需要更多數量的細胞,通常有250000個細胞/孔。當頻率較高時,例如在10個細胞中就有1個,那么我們僅需要大約5000個細胞/孔就足夠了。
2. 測定細胞線性度
在分析中,如果發現細胞沒有成線性關系,可能是由于細胞數量不夠,或者細胞刺激不夠造成的。比如當分析抗原特異性T細胞時,PBMC細胞數不應低于每孔200000個細胞。
3. 激活
在加入細胞之前,應將刺激物添加到孔板中,或者刺激物與細胞混勻后一起加入到孔板中。細胞被添加到孔板中后就不能再添加更多的培養基,因為后加入的培養基會使細胞向邊緣周圍擴散。在ELISPOT/FLUPOSBOT讀板前,應清洗細胞以避免膜的背景染色。在B細胞ELISPOT實驗中洗板是很重要的。
4. 動力學
在建立最佳細胞孵育時間時,應考慮蛋白質分泌的動力學因素。某些分析物僅在刺激超過24小時后才會分泌。
5. 濕度
我們要確保足夠的濕度來培養細胞。建議培養過程中用錫箔紙包裹孔板,避免蒸發。一般的建議,37°C ,5% CO2孵育細胞。
6. 靜置
避免細胞在培養過程中突然移動,因為這將對斑點的形成產生不利的影響。




