
【流式學習】10分鐘梳理流式染色中固定的常見問題

-
檢測細胞內指標
-
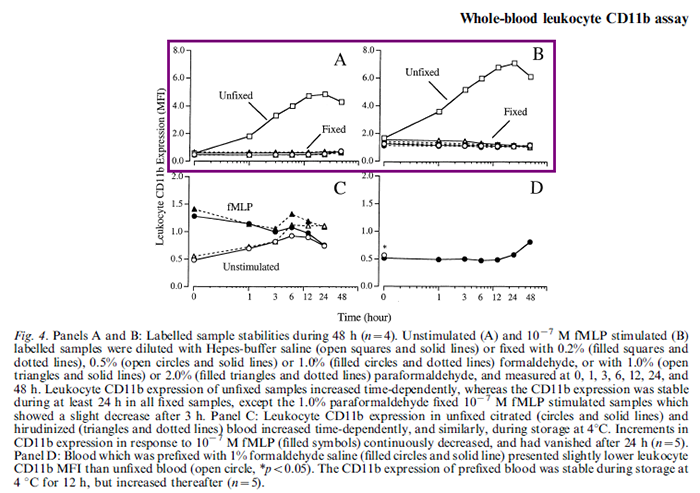
延長樣本的保存,獲得充足的上機時間。
-
生物安全性考慮
-
對蛋白翻譯后修飾的檢測
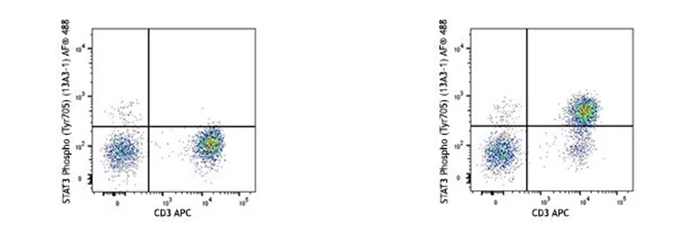
在蛋白翻譯后修飾(磷酸化、乙酰化、甲基化等)的研究過程中,固定劑不僅可以有效的“固定”住翻譯后修飾的位點(絲氨酸、蘇氨酸、酪氨酸等),也可以防止目標位點在活細胞中很快降解(比如磷酸酶會去除磷酸化修飾、去甲基化酶會移除甲基化修飾等)。下面的例子是用IL-6的重組蛋白刺激人外周血15分鐘后看STAT3第705位酪氨酸的磷酸化水平,在刺激完樣本后就需要通過固定來實現目的氨基酸磷酸化水平“停留”在IL-6刺激15分鐘這個節點上。
-
脫水劑類(如乙醇、甲醇)
-
交聯劑類(如甲醛、戊二醛)
理想的固定劑能使抗原固定,同時保持細胞、亞細胞結構的真實性,同時能夠保證抗體與所有細胞及亞細胞結構內抗原的充分接觸。但“理想很豐滿,現實很骨干”,固定的過程或多或少對流式檢測帶來一些影響,只有了解了固定對流式染色帶來的影響我們才能更好的做好流式實驗。
-
固定對熒光染料的影響是什么?
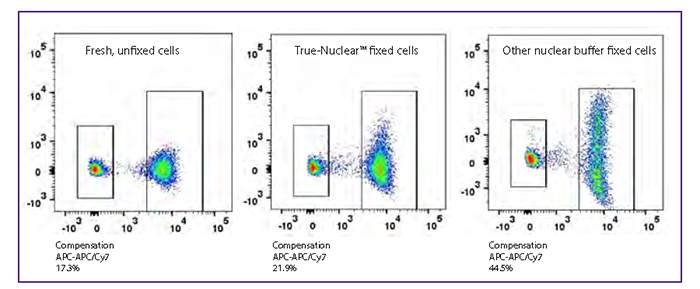
主要表現在固定劑對串聯染料(tandem-dye,如APC/Cy7、PE/Cy7等)的影響:一個是固定劑有可能造成串聯染料的斷裂,比如APC-Cy7和4%多聚甲醛溶液接觸時間超過4個小時染料就有可能斷裂,所以如果細胞直接重懸在固定液里面建議盡快上機,如果要放到第二天上機,需離心去除固定液后重懸在流式染色液或者是PBS里面,當然有一些新的串聯熒光素可以有效減少這種情況,比如BioLegend的APC/Fire750TM染料。
另外一個是固定劑有可能造成串聯染料的熒光“溢漏(spillover)”增加,對于這類情況的建議是配色允許的情況下減少串聯染料的使用(但實際上很多多色panel來說,這都不算是一個解決方案);另外,使用一些商業化的固定buffer,也有可以在一定程度上減少熒光“溢漏”,如下圖所示:
-
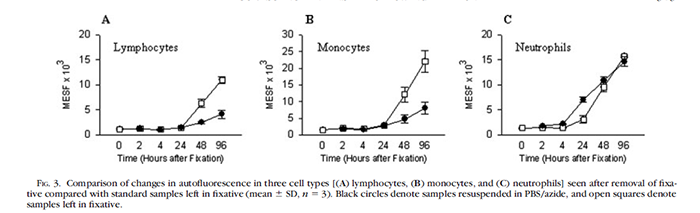
4%多聚甲醛溶液固定后的樣本可以保存多久?
一般建議不要超過24個小時,固定后的樣本放置時間越久,背景信號會越高,即使固定后的細胞重懸在不含固定劑成分的緩沖液中也會造成背景升高(我們建議固定后的樣本離心除去固定劑,重懸在流式染色緩沖液或者PBS里面)。
如果需要長時間保存樣本,建議在樣本做完表面染色和固定后,保存在專門的保存緩沖液中。但即便是有專門的保存buffer,對于用了串聯染料(如APC/Cy7、PE/Cy7等)染色的樣本,我們還是建議不要長時間保存,很難避免補償的“漂移(shift)”。
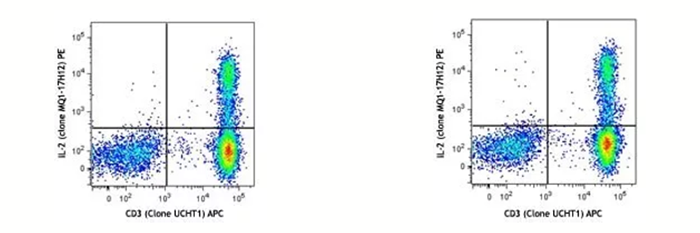
左圖:human PBMC刺激完當天染色后上機檢測;右圖:同一樣本,表染和固定后,保存在Cyto-Last? buffer里面,14天后做胞內染色并上機。
-
Ki-67染色時,選擇哪種固定方式?
流式在檢測一些特殊的核內指標時,一般都會有推薦的固定破膜方案。比如在Ki-67染色一般會推薦用70%的冰乙醇作為固定劑(含打孔作用),如前文提到的脫水劑類固定劑對蛋白空構象的影響大,在單染Ki-67的時候,乙醇的固定方式是完全沒有問題的,但是在和其它指標共染時,就需要考慮乙醇固定的方式和其它抗體兼容性的問題,比如CD38 (Clone: HIT2)的抗體是明確不能和乙醇固定的方式兼容,而CD34 (Clone: 581)很大程度上可以兼容這種固定方式。醇類和其它抗體(Clone)的兼容性很難一一驗證,所以在做Ki-67染色的時候我們也會用FOXP3的固定/破膜方式來替代乙醇的方案,而且大多數時候是可以獲得不錯的染色結果。
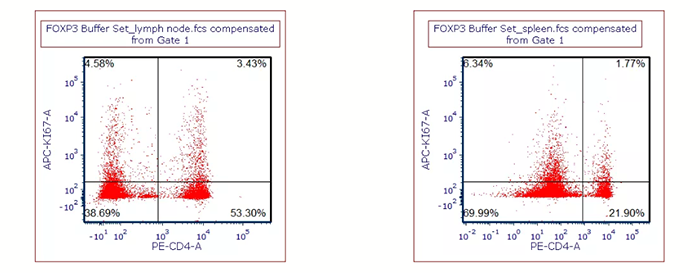
用BioLegend FOXP3 Buffer set對細胞進行固定破膜處理后,染Ki-67抗體,左圖:小鼠淋巴結樣本;右圖:小鼠脾臟樣本。
-
對于需要先固定再染色的樣本,注意點在哪里?
流式實驗中,有一些情況我們希望或需要對樣本進行預先固定處理,比如前文說過的傳染病人的樣本或者是需要檢測蛋白翻譯后修飾的樣本。對于需要預固定的樣本,首先需要考慮預先固定處理對檢測指標的影響,有很多指標先染色再固定和先固定再染色出來結果差異非常大,導致這些差異原因和指標的類型、抗體的克隆號等因素都有關系。
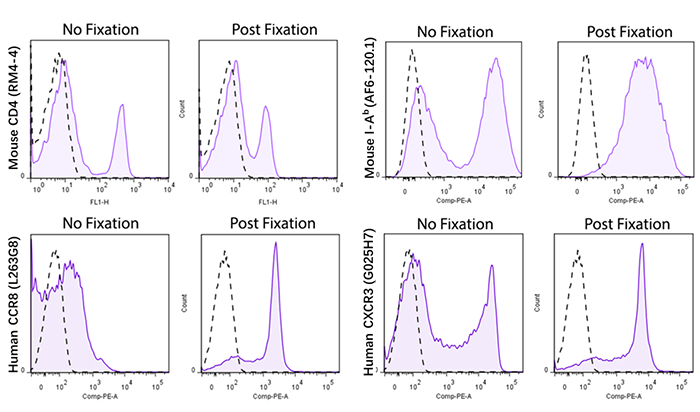
如果我們的流式實驗要求對樣本進行預先固定的處理,那實際上這就需要提前去驗證染色方案里所選的克隆是否適用于先固定后染色,這也有一定工作量。推薦大家參考借鑒BioLegend關于固定的專題,里面有做了很多克隆能否適用于先固定后染色的驗證。
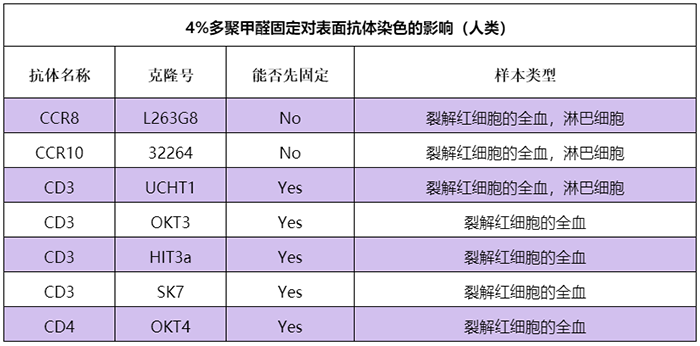
對比信息請參考:www.biolegend.com/fixation
-
樣本需要先固定再染色,但方案里的一些指標不兼容預先固定,該怎么辦?
這個問題其實相當棘手,因為據我們了解的情況,目前市面上還沒有一個試劑生產廠家有這樣“完美”固定試劑可以先固定樣本而不對后續染色產生任何影響,如果有的話,那我們今天所說的關于固定的問題,都不算是問題。
在實際遇到預固定和指標不兼容時,我們會做如下建議:(1)使用替代指標來更換那些受固定影響的指標;(2)如果沒有可以替代指標,請根據實驗重要性原則來取舍檢測指標,比如是磷酸化的指標會比表面的指標更為重要。雖然這一段看起來有一點像“廢話”,但我們需要在實際實驗過程中學會做取舍和判斷。
-
Cossarizza A, Chang HD, Radbruch A, et al.Guidelines for the use of flow cytometry and cell sorting in immunologicalstudies. Eur J Immunol. 2017 Oct; 47(10):1584-1797.
-
Li N, Hallde?n G, Hjemdahl P. A whole-blood flow cytometric assay for leukocyte CD11b expression using fluorescencesignal triggering. Eur J Haematol. 2000: 65:57±65.
-
Judith C. Stewart, Michelle L. Villasmil andMark W. Frampton. Changes in Fluorescence Intensity of Selected LeukocyteSurface Markers Following Fixation. Cytometry A. 2007 Jun;71(6):379-85.




