
哺乳動物細胞表達系統中,關于蛋白純化的難點和解決方案,了解一下!

先前小達君給大家介紹了Strep-tag? 的歷史(點此回顧您想了解的Strep-tag:Strep-Tactin?XT發展史都在這里!),現在再隆重介紹 Strep-tag? 在哺乳類細胞表達系統的應用。另外,小達君保證您看完后會心動,然后回來參加活動(點此參加分享IBA蛋白純化體驗,獲贈蛋白純化填料哦!),獲贈蛋白純化填料哦!
雖然大腸桿菌E.coli表達系統經濟實惠,但由于缺乏重要的脂類,分子螫合物,以及重要的翻譯后修飾,用它表達真核蛋白,可能會影響蛋白本身的折疊及功能,以膜蛋白為例,大腸桿菌表達系統能影響目標蛋白在細胞膜的插入位置及其應有的功能[1]。除此之外,當目標蛋白大于50kDa時,使用大腸桿菌系統可能表達出不完整的蛋白[2]。
所以,為了研究特定蛋白的功能(如:信號通路),生產較大型的蛋白,或進行高解析度的結構分析,愈來愈多的實驗室選擇哺乳類表達系統來生產融合蛋白。其原因為哺乳動物細胞生產出的重組蛋白與人類蛋白十分相似,有較完整的蛋白折疊、組合及翻譯后修飾[3]。因此,愈來愈多科學家們更加關注于—如何從哺乳類細胞中高效的純化目標蛋白。
1.親和標簽的選擇
首先,需考慮選擇合適的親和標簽。常用于哺乳動物表達系統的親和標簽有His-tag、FLAG-tag、GST-tag及Strep-tag?等[4-12],整理于下表:
|
親和標簽 |
氨基酸數量 |
配體 |
平衡解離常數(Kd) 范圍 |
洗脫方式 |
一步驟 |
|
His-tag |
2-10, 多為6 |
Ni2+-NTA, |
nM |
Imidazole 20–250 mM或low pH |
* |
|
FLAG-tag, 3x FLAG |
8, 22 |
抗Flag抗體 |
nM |
pH 3.0;2–5 mM EDTA或FLAG短肽 |
*** |
|
Glutathione S-transferase (GST-tag) |
211 |
Glutathione |
nM |
5–10 mM reduced glutathione |
** |
|
Strep-tag?II (ST), Twin-Strep-tag? (TST) |
8, 28 |
Strep-Tactin? |
nM (with TST) |
2.5 mM desthiobiotin |
*** |
|
Strep-Tactin?XT |
pM (with TST) |
50 mM biotin |
*** |
*這些親和標簽在使用上各有千秋。
使用His-tag時,常遇到的問題是寄主蛋白與填料的非特異性結合,在哺乳動物重組蛋白的純化過程中,這樣的情況更為明顯。由于系統中有很多含有組氨酸(histidine)的殘基的蛋白,這種蛋白結構與his-tag相似,容易與鎳柱結合,因此導致目標蛋白純度降低[13]。
FLAG-tag系統可在非變性條件下進行純化,能得到高純度、有活性的蛋白,但其缺點為純化介質較為不穩定,且純化成本高上許多[5]。
另一常用的標簽為GST-tag,一個26kDa的蛋白,其特點是表達量高,具高度抗原性,常用來增加目標蛋白的溶解度,但常常會影響目標蛋白的特性,一般推薦純化后將標簽去除[8]。
而Strep-tag?(包含Strep-tag?II或是Twin-Strep-tag?),都是短肽標簽,分別為8或28個氨基酸,一般不干擾蛋白折疊或活性,因此適合用于蛋白功能性研究[5]。Strep-tag?可以特異性地結合在Strep-Tactin?(二代介質)或Strep-Tactin?XT(三代介質)的生物素的結合位點。洗脫時使用的脫硫生物素(適用于二代)或生物素(三代),對同樣的結合位點有更高的親和力,能將目標蛋白從同樣位置移除,因此得到的目標蛋白純度一般高于95%[12]。
同時,三代的 Strep-Tactin?XT與Strep-tag?蛋白的親和力大幅提升,直接加入含目標蛋白的哺乳細胞的培養上清,即可高效純化出所需蛋白(注:原本使用二代需先以Avidin或是BioLock將培養基中的生物素遮蔽,才不會影響純化表現)。
2.三代Strep-Tactin?XT親和力顯著
圖A比較了His-tag與Strep-tag?直接加入哺乳細胞培養上清純化目標蛋白的表現。

圖A
圖A:分別向Strep-Tactin?XT High Capacity 1ml重力柱(左)和Ni-NTA 1ml重力柱(右)中,同時加入含4mg mCherry-Twin-Strep-tag (TST)或mCherry-His-tag (His)螢光蛋白的ExpiCHO細胞培養上清(注:接下來的實驗皆是取哺乳細胞表達某抗體后的上清,另加入高純度目標蛋白進行實驗)。由圖可見,Strep-Tactin?XT(左)能高效率的捕捉mCherry-TST,而右方的mCherry-His幾乎無法掛柱。
此外,我們也測試了其他的蛋白,例如SEAP(72 kDa)或抗體(mAb,其重鏈為55kDa)。圖B為以Strep-Tactin?XT純化SEAP-TST、mCherry-TST與mAb-TST的SDS-PAGE分析結果,可見對于不同蛋白,Strep-tag?系統都能純化出高純度的目標蛋白。(注:紅色標記處為 mCherry的降解產物,非雜帶)
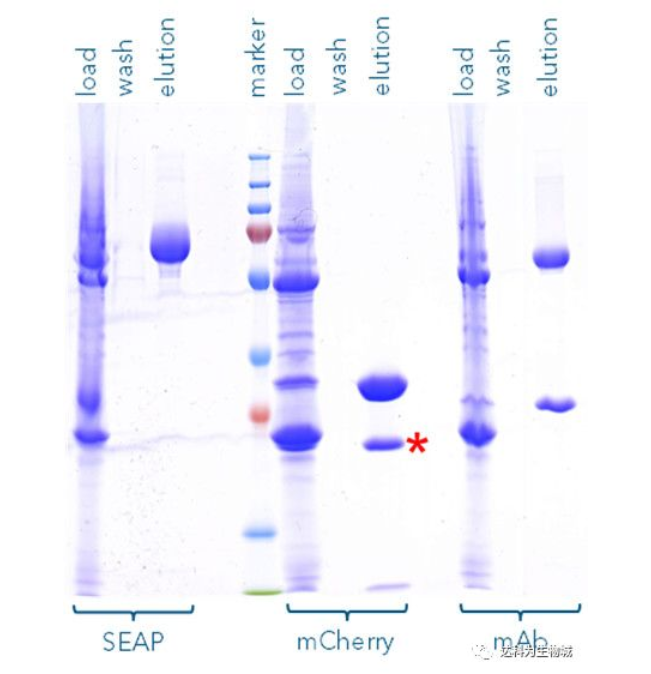
圖B
因Strep-Tactin?XT與Twin-Strep-tag蛋白的高親和力,即使目標蛋白的濃度低,使用Strep-Tactin?XT仍可以有效的捕捉上清中的目標蛋白。表C整理了幾個實驗的數據,顯示當目標蛋白濃度低于20μg/ml時,得率仍能達到幾近100%。
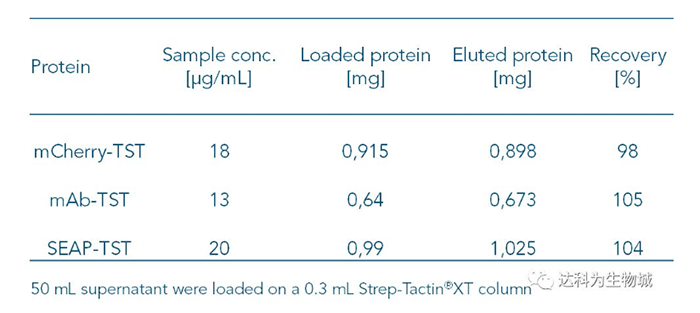
表C
3.Strep-Tactin?XT普適性高
除了上述實驗所用的CHO細胞株外(中國倉鼠卵巢細胞),另一常用于生產蛋白的哺乳動物細胞株為HEK293(人胚胎腎細胞),使用上較CHO簡單。我們測試了Strep-Tactin?XT的純化表現:表D1為以Expi293表達SEAP-TST或mAb-TST蛋白后,目標蛋白的濃度。圖D2為純化表現的SDS-PAGE分析。從中可知,與ExpiCHO培養基相同,直接將表達好的Expi293上清加入1ml Strep-Tactin?XT高載量重力柱中進行純化,一樣能夠快速的得到高純度的目標蛋白。
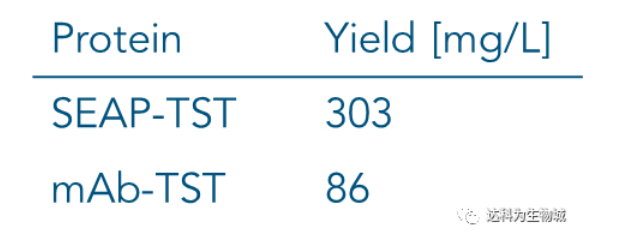
表D1
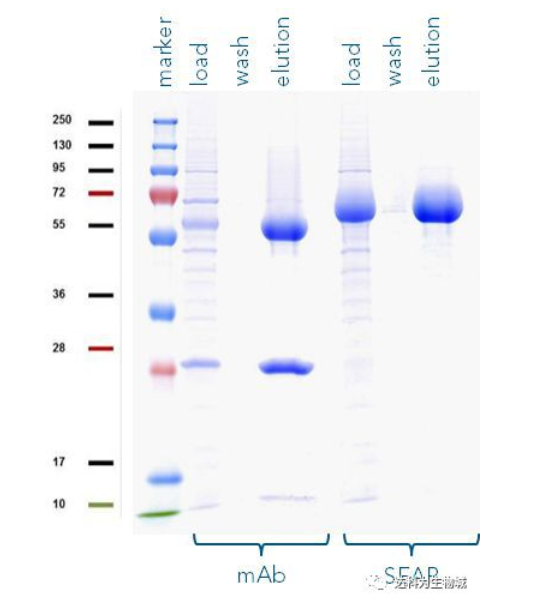
圖D2
綜上所述,Strep-tag?非常適合用在哺乳動物細胞系中表達目標蛋白,其純化過程也與常見的ExpiCHO及Expi293培養基相容,不須另外處理,讓實驗流程更為便利。加上Strep-tag?系統在純度上的優勢,是目前在這個應用上的絕佳選擇。
4. IBA哺乳動物細胞表達/純化蛋白相關產品
產品信息
表E1 含Twin-Strep-tag?的哺乳動物細胞表達載體
|
名稱 |
貨號 |
Twin-Strep-tag? |
分泌信號 |
規格 |
網站報價 |
|
|
N端 |
C端 |
|||||
|
pCSG-IBA105 |
5-5105-001 |
√ |
|
|
5ug |
¥3,174 |
|
pESG-IBA105 |
5-4505-001 |
√ |
|
|
5ug |
¥3,174 |
|
pCSG-IBA103 |
5-5103-001 |
|
√ |
|
5ug |
¥3,174 |
|
pESG-IBA103 |
5-4503-001 |
|
√ |
|
5ug |
¥3,174 |
|
pCSG-IBA104 |
5-5104-001 |
√ |
|
√ |
5ug |
¥3,174 |
|
pESG-IBA104 |
5-4504-001 |
√ |
|
√ |
5ug |
¥3,174 |
|
pCSG-IBA102 |
5-5102-001 |
|
√ |
√ |
5ug |
¥3,174 |
|
pESG-IBA102 |
5-4502-001 |
|
√ |
√ |
5ug |
¥3,174 |
表E2 pCSG與pESG的區別
|
載體系列/內建基因 |
pCSG |
pESG |
|
CMV Promoter |
√ |
√ |
|
oriP |
√ |
|
|
EBNA-1 |
√ |
|
|
SV40 origin |
√ |
√ |
|
NeoR |
√ |
√ |
|
CoIE1 + Amp |
√ |
√ |
|
BM40 |
√ |
√ |
表E3 IBA三代產品信息
|
名稱 |
貨號 |
規格 |
網站報價 |
|
Strep-Tactin?XT Superflow? 50% suspension |
2-4010-002 |
4 ml |
¥1,365 |
|
2-4010-010 |
20 ml |
¥4,814 |
|
|
2-4010-025 |
50 ml |
¥11,437 |
|
|
Strep-Tactin?XT Superflow? gravity flow columns |
2-4011-005 |
5×0.2 ml |
¥2,361 |
|
2-4012-001 |
1 ml |
¥1,012 |
|
|
2-4013-001 |
5 ml |
¥3,051 |
|
|
2-4014-001 |
10 ml |
¥5,734 |
|
|
Strep-Tactin?XT Superflow? cartridges (for ?kta/peristaltic pumps) |
2-4021-001 |
1 ml |
¥1,181 |
|
2-4022-001 |
5 ml |
¥3,051 |
|
|
Strep-Tactin?XT Superflow? high capacity 50% suspension |
2-4030-002 |
4 ml |
¥1,824 |
|
2-4030-010 |
20 ml |
¥6,562 |
|
|
2-4030-025 |
50 ml |
¥15,178 |
|
|
Strep-Tactin?XT Superflow? high capacity gravity flow columns |
2-4031-005 |
5×0.2 ml |
¥3,051 |
|
2-4032-001 |
1 ml |
¥1,365 |
|
|
2-4033-001 |
5 ml |
¥4,186 |
|
|
2-4034-001 |
10 ml |
¥7,880 |
|
|
Strep-Tactin?XT Superflow? high capacity cartridges (for ?kta/peristaltic pumps) |
2-4025-001 |
1 ml |
¥1,518 |
|
2-4026-001 |
5 ml |
¥4,431 |
|
|
MagStrep "type3"XT beads 5% suspension |
2-4090-002 |
2 ml |
¥2,724 |
|
Strep-Tactin?XT Spin Column Kit |
2-4151-000 |
1 kit |
¥2,300 |
|
Strep-Tactin?XT immobilization plate |
2-4101-001 |
1 plate |
¥796 |
|
Twin-Strep-tag? Capture Kit |
2-4370-000 |
1 kit |
請咨詢 |
參考文獻
[1] Sahdev S, Khattar SK, Saini KS (2008). Production of active eukaryotic proteins through bacterial expression systems: a review of the existing biotechnology strategies. Mol Cell Biochem., 307(1-2):249-64
[2] Dyson MR, Shadbolt SP, Vincent KJ, Perera RL, Mccafferty J (2004). Production of soluble mammalian proteins in Escherichia coli: identification of protein features that correlate with successful expression. BMC Biotechnol., 4:32. doi: 10.1186/1472-6750-4-32
[3] Khan KH (2013). Gene Expression in Mammalian Cells and its Applications. Adv Pharm Bull., 3(2): 257-63. doi: 10.5681/apb.2013.042
[4] Wegner GJ, Lee HJ, Corn RM (2002). Characterization and optimization of peptide arrays for the study of epitope-antibody interactions using surface plasmon resonance imaging. Anal Chem., 74(20):5161-8.
[5] Terpe K (2003). Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems. Appl.Microbiol.Biotechnol.,60(5): 523-33. doi: 10.1007/s00253-002-1158-6
[6] Lichty JJ, Malecki JL, Agnew HD, Michelson-Horowitz DJ, Tan S (2005). Comparison of affinity tags for protein purification. Protein Expr Purif., 41(1):98-105.
[7] Tessema M, Simons PC, Cimino DF, Sanchez L, Waller A, Posner RG, Wandinger-Ness A, Prossnitz ER, Sklar LA (2006). Glutathione-S-transferase-green fluorescent protein fusion protein reveals slow dissociation from high site density beads and measures free GSH. Cytometry A., 69(5):326-34.
[8] Kimple ME, Brill AL, Pasker RL (2013). Overview of affinity tags for protein purification. Curr Protoc Protein Sci., 73: Unit 9.9. doi: 10.1002/0471140864.ps0909s73.
[9] GE Healthcare (2016). Affinity Chromatography Handbook, Vol. 2: Tagged Proteins.
[10] Thermo Fisher Scientific (2015). Protein Expression Handbook
[11] Dynamic Biosensors (2018) Application Note: High-affinity capturing of tagged proteins on the switchSENSE? biochip using Strep-Tactin?XT.
[12] IBA Lifesciences (2016) Application Note: Strep-Tactin?XT:Twin-Strep-tag?- Advantages compared to the His-tag purification system.
[13] Bornhorst JA, Falke JJ (2000). Purification of proteins using polyhistidine affinity tags. Methods Enzymol., 326:245-54.
IBA lifesciences(德國):IBA公司總部位于德國。二十年來,IBA以杰出的專利技術Strep-tag?系統為基礎,發展出完整的產品組合,涵蓋重組蛋白表達純化與固定以及特定細胞從全血或相關體液中分離的技術。同時,IBA也是全球領先的核酸合成專家,在DNA及RNA寡核苷酸的合成上已有超過二十年的經驗,能根據客戶的選擇,生產含有特定染料或化學修飾的特殊寡核苷酸。




