
您想了解的Strep-tag:Strep-Tactin?XT發展史都在這里!

有用過His-tag進行蛋白純化的人,或多或少都有這樣的經驗 : 蛋白純度低、純化出來的蛋白失去原有結構或功能受到影響、難以從哺乳類細胞表達系統中純化出目標蛋白…等,因此科學家開始嘗試以不同親和標簽進行蛋白純化。因為Strep-tag系統的純化過程溫和、目標蛋白純度高,且相容于多種表達系統的特性,愈來愈受到大眾的歡迎。但是,你知道Strep-tag這個純化系統是怎么發展而來的嗎? 這得從功能性抗體開始說起…
功能性抗體的出現
隨著生物制藥技術的發展,抗體也因此成為科學家研究的熱門領域。但在80年代初,功能性抗體的表達一直是個問題,酵母表達系統中表達出來的蛋白只有部分具有功能,在其他的微生物表達系統中,也沒有成功的先例。一直到80年代末,一個具有功能性的McPC603抗體的Fv片段終于成功的在E. coli中被表達出來1。這一方法的出現,使得科學家能更快速的表達具有不同基因變異的抗體片段,并能對這些變異所引發的功能改變進行檢視。
抗體純化沒有想象中那么簡單
更高能的短肽標簽呼之欲出
要解決這些問題,科學家需要找出一個具備以下功能的短肽簽。
1.能被融合到目標蛋白上,且不會影響蛋白功能
2.能直接以現有試劑偵測出來
3.與配體的結合穩定、特異性高且容易控制。
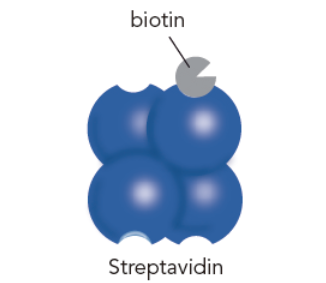
經過一番搜索,發現鏈霉親和素(Streptavidin)在特定情況下,能與不同短肽進行可逆性的結合,再加上其與生物素(biotin)極高的親合力,且與背景蛋白的非特異性結合機率低,鏈霉親和素已被應用在許多檢測系統中,甚至能做為一個穩定的介質來固定蛋白。另外,鏈霉親和素在不同溶液條件中穩定性好,較抗體來的高,所以能夠重復被利用。因此,90年代初,科學家開始尋找一個能與鏈霉親和素特異性結合的親和標簽2。
終于找到了第一代Strep-tag系統 : Strep-tag vs Streptavidin
因先前已知可用E.coli系統表達出具有功能性的Fv片段1,科學家又希望能確認標簽是否會影響蛋白功能,所以選擇了已知的D1.3抗體Fv片段做為實驗模型,以便檢測加上的短肽標簽是否影響了這片段與其抗原結合的特性3。接著,一連串能與鏈霉親和素結合的標簽被接到VH domain上,大量篩選之后,得到了一個適用于進行一步純化的Strep-tag (Trp-Arg-His-Pro-Gln-Phe-Gly-Gly) 3,與生物素相比,Strep-tag和鏈霉親和素間的親和力較低,因此可以使用生物素衍生物Diaminobiotin,在生理條件下進行溫和洗脫。又因整個純化流程溫合,含鹽濃度低,純化出來的 Fv片段完整且功能不受影響3。除此之外,這個標簽還能被應用在Western blot或ELISA實驗中,以鏈霉親和素酶偶聯物(Streptavidin-enzyme conjugates)來檢測純化出的Fv片段。后續也測試了以Strep-tag來純化抗體以外蛋白的可能性,證實了這個一步純化系統可以被廣泛使用在不同類型的蛋白上3。
因為不完美,所以有了第二代 : Strep-tag II vs Strep-Tactin?
但Strep-tag僅能接在目標蛋白的C端,對于需將標簽接在N端或是蛋白內部的實驗,非常的不實用。因此科學家進一步優化了這個標簽,便有了現在被廣泛使用的Strep-tag II (Trp-Ser-His-Pro-Gln-Phe-Glu-Lys)4。但即便足以用于蛋白純化,科學家對Strep-tag II與鏈霉親和素的結合強度低這點仍不甚滿意,因為在比較特殊的純化條件中效率會受影響。于是進行了鏈霉親和素的改造,發展出Strep-Tactin?。Strep-Tactin?:Strep-tag II的親和力較Streptavidin:Strep-tag II提升了近100倍,這個改變使得洗脫時需改用脫硫生物素(Desthiobiotin) 5,但過程一樣溫合。這就是二代Strep-tag系統,在過去近20年間,逐漸被廣泛應用于純化或偵測蛋白質中,甚至發展出細胞分離檢測的方法6。
總覺得還能更好,一起看看第三代 : Twin-Strep-tag vs Strep-Tactin?XT
即便親和力已提升,在某些狀況下,Strep-Tactin?使用仍有所限制,尤其是在需要極高親和力的應用之中,例如檢測蛋白質間的交互作用、或是從目標蛋白濃度低的樣本中進行純化。因此科學家利用總結合力(Avidity)的原理,將兩個Strep-tag II以Linker連接在一起 : Twin-Strep-tag 7。這一新標簽的出現再度提升了目標蛋白與Strep-Tactin?的鏈接強度,改善了低濃度樣本純化效果8,還能用于抓取蛋白復合體、檢測蛋白間的交互作用7, 9。
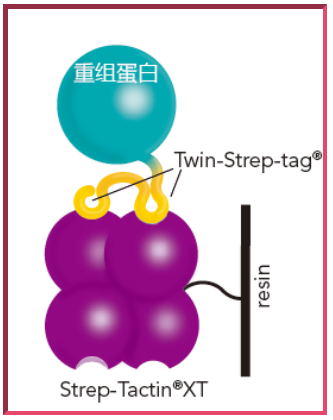
美中不足的是,Strep-Tactin?在變性條件下并不穩定(例如:使用尿素時),無法進行純化,且進行批量純化時,即使搭配Twin-Strep-tag,效果仍有改善的空間。為此,科學家再次改造了Strep-Tactin?,得到與Twin-Strep-tag親和力更上一層樓的Strep-Tactin?XT (XT意指extreme tight) 10。經過這次的優化,科學家首次創造出一個純化系統,其中標簽與配體的鍵結力幾近共價,但鏈結仍保持可逆 (注:Strep-tag II也能與Strep-Tactin?XT結合)。因親和力的增加,即使經過多次清洗步驟,蛋白也不會從Strep-Tactin?XT上解離,提高了目標蛋白的得率。需注意的是,洗脫步驟必須使用生物素,但是整個純化流程與前幾代一樣溫合,純度超過95%,這就是 新一代Strep-tag系統。用Strep-Tactin?XT來純化時,得率及純度都提高;且Twin-Strep-tag搭配后還能用在Biacore芯片11, 12、微量滴定板或ELISA中來固定蛋白,進行后續檢測,是一個多用途的親和標簽系統。
心動不如行動,快來體驗Strep-tag純化系統
產品介紹請見https://www.iba-lifesciences.com/lp-streptactinxt-cn.html
Strep-tag與His-tag系統的比較
想知道Strep-tag與His-tag的實際比較數據嗎? 請下載產品彩頁https://www.biomart.cn/infosupply/35669016.htm
試用申請→請郵件 tech_cell@dakewe.net
參考文獻
IBA Lifesciences公司簡介
IBA Lifesciences(德國)是后基因組時代表達克隆和蛋白質純化技術 重要的供應商之一。該公司的產品線分成三部分:一是開發了Strep-tag?的通用技術平臺,可快速、多樣性地生產、純化和使用重組蛋白;二是細胞分選與擴增產品組合;三是定制化核酸合成服務。




